| (2.13) |
Im Falle der Bildung von Präzipitaten können sich mitunter sehr viele Atome aneinander binden. Ein Vertreter dieser Gruppe sind die sogenannten {311}-Defekte. Diese Defekte sind flächenhafter Natur an den Zwischengitterplätzen in der {311}-Ebene des Siliziumkristalls [Dun93].
Naturgemäß beeinflußt die Größe und Form des Präzipitates die Koeffizienten der
generellen Reaktionsgleichung Gl. 2.7. Die Bindungsenergie eines Atoms an ein
Präzipitat der Größe n entspricht der Differenz in der freien Gibbs'schen Energie
für das Gesamtsystem vor und nach der Reaktion:
| (2.13) |
Während die Reduktion des chemischen Potentials proportional zur Anzahl der gebundenen Atome
verläuft, hängt ![]() einerseits von der Größe der Oberfläche und andererseits
vom Verformungsvolumen ab. Die Oberfläche und die darin gespeicherte Energie nimmt nur
sublinear zu. Die Oberfläche eines kugelförmigen Präzipitates aus n Atomen errechnet sich
zu
einerseits von der Größe der Oberfläche und andererseits
vom Verformungsvolumen ab. Die Oberfläche und die darin gespeicherte Energie nimmt nur
sublinear zu. Die Oberfläche eines kugelförmigen Präzipitates aus n Atomen errechnet sich
zu ![]() , wenn Va das Volumen eines Atomes im
Präzipitat ist. Je nach Form des Präzipitates erhält man unterschiedliche Zusammenhänge, die
jedoch immer sublinear sind. Die gespeicherte mechanische Verformungsenergie ist hingegen
proportional dem Quadrat der resultierenden Volumsänderung und dem Elastizitätsmodul
E [Dun93]:
, wenn Va das Volumen eines Atomes im
Präzipitat ist. Je nach Form des Präzipitates erhält man unterschiedliche Zusammenhänge, die
jedoch immer sublinear sind. Die gespeicherte mechanische Verformungsenergie ist hingegen
proportional dem Quadrat der resultierenden Volumsänderung und dem Elastizitätsmodul
E [Dun93]:
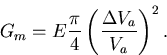 |
(2.15) |
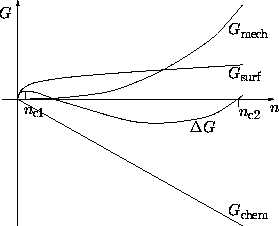 |
Es existieren in der Regel Präzipitate verschiedenster Größen gleichzeitig und konkurrieren
um die freien Atome. Die Reaktionskinetik wird durch die Umwandlungsraten von Präzipitaten mit
n Atomen zu Präzipitaten mit n+1 Atomen beschrieben,
Die zeitliche Entwicklung der Größenverteilung von Cn wird durch die Erhaltungsgleichungen
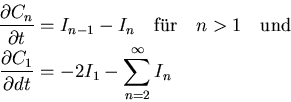 |
(2.17) |
Die Gleichgewichtskonzentrationen Cn* können mit Hilfe von Gl. 2.14 zu
Der Spielraum zur Modellierung der Präzipitation liegt in der Gestaltung der gespeicherten
Oberflächen- und Deformationsenergie ![]() , der Löslichkeitsgrenze
, der Löslichkeitsgrenze ![]() und
den effektiven Reaktionsgeschwindigkeiten
und
den effektiven Reaktionsgeschwindigkeiten ![]() .
.